Headline
Undang-Undang Cipta Kerja dituding sebagai biang keladi. Kini juga diperparah Peraturan Menteri Perdagangan No 8 Tahun 2024 yang merelaksasi impor.
Undang-Undang Cipta Kerja dituding sebagai biang keladi. Kini juga diperparah Peraturan Menteri Perdagangan No 8 Tahun 2024 yang merelaksasi impor.
 Kumpulan Berita DPR RI
Kumpulan Berita DPR RI
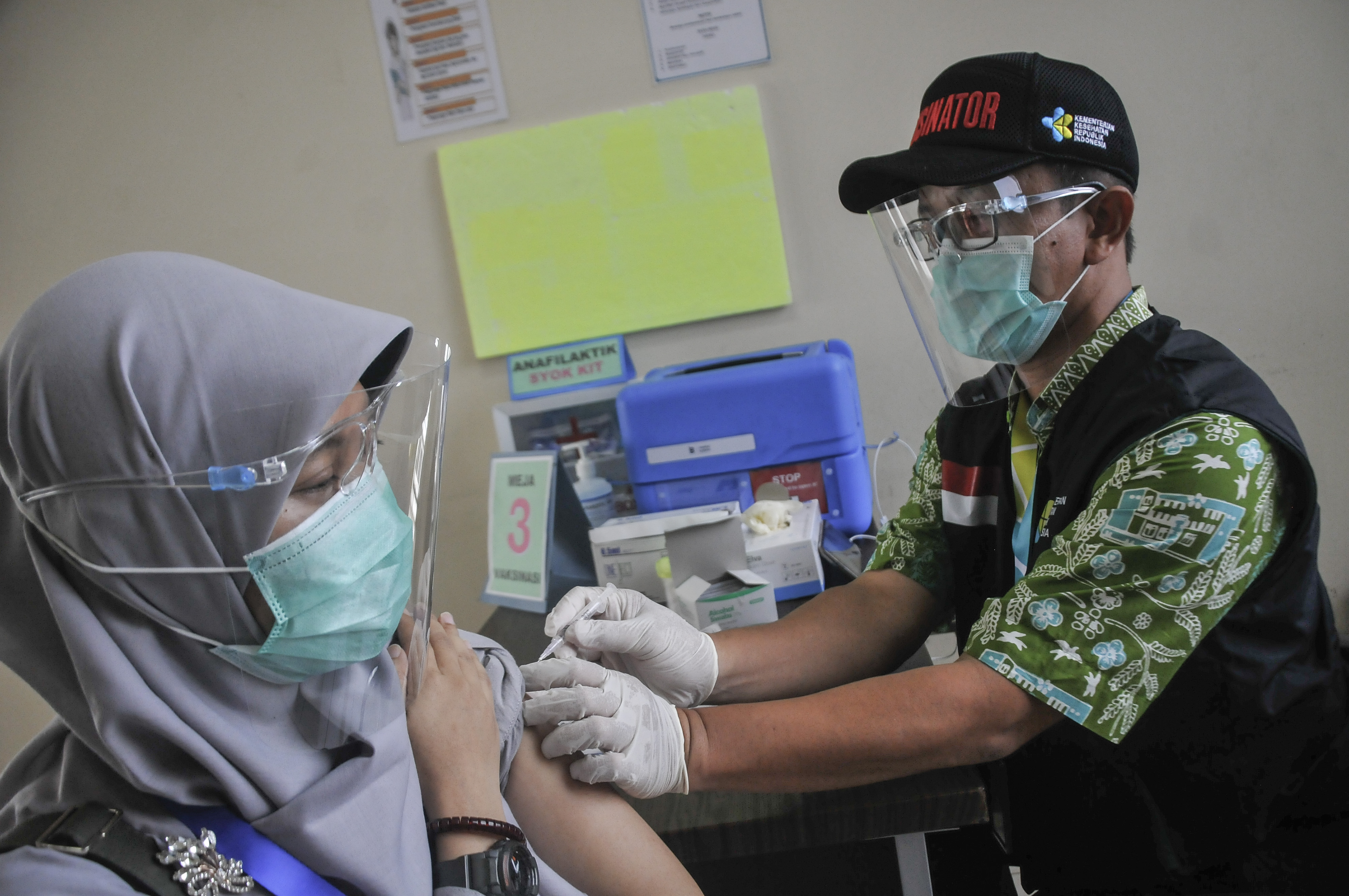
BADAN Pengawasan Obat dan Makanan (POM) terus mengawal pelaksanaan uji klinik vaksin sinovac, yang sekarang di tahap 3, mulai dari percepatan proses evaluasi dalam rangka pemberian Persetujuan Protokol Uji Klinik (PPUK) hingga pelaksanaan inspeksi untuk memastikan pelaksanaan uji klinik sesuai dengan protokol yang disetujui dan ketentuan pelaksanaan Cara Uji Klinik yang Baik (CUKB) atau Good Clinical Practice.
“Untuk dapat diterbitkan persetujuan penggunaan atau izin edar, vaksin harus memenuhi persyaratan keamanan, khasiat, dan mutu sesuai standar yang telah ditetapkan. Data khasiat dan keamanan diperoleh dari hasil uji klinik, sementara data mutu diperoleh dari pemenuhan spesifikasi produk vaksin dari bahan awal hingga produk jadi,” kata Kepala Badan POM RI, Penny K. Lukito saat konferensi terkait perkembangan uji klinik vaksin covid-19, Kamis (19/11).
Pemantauan terhadap keamanan subjek uji klinik juga dilakukan oleh Komite Etik Penelitian Kesehatan Univesitas Padjadjaran. “Dari hasil inspeksi yang dilakukan, sejauh ini uji klinik telah dilaksanakan dengan baik. Belum ada KTD atau efek samping serius yang dialami oleh subjek uji klinik,” sebut Penny.
Untuk mendukung data mutu uji klinik vaksin sinovac, Badan POM telah melakukan inspeksi ke fasilitas produksi Sinovac Life Science Beijing pada 2 hingga 5 November 2020. Inspeksi dilakukan secara komprehensif untuk memastikan produsen menerapkan standar Cara Pembuatan Obat yang Baik (CPOB) secara konsisten di sepanjang proses pembuatan vaksin, mulai dari pembuatan bahan baku vaksin (upstream), formulasi vaksin (downstream), hingga proses filling ke dalam vial menjadi produk jadi.
Selanjutnya, ujar Penny, keseluruhan data aspek keamanan, khasiat, dan mutu tersebut harus disampaikan oleh industri farmasi kepada Badan POM untuk dilakukan proses evaluasi yang mengacu pada standar pedoman evaluasi nasional dan internasional.
Proses evaluasi dilakukan oleh Badan POM melalui pembahasan bersama Komite Nasional Penilai Obat, tenaga ahli, dan klinisi dari Ikatan Dokter Indonesia. Khusus untuk vaksin, pembahasan dilakukan bersama ITAGI (Indonesia Technical Advisory Group on Immunization).
“Kami berharap agar PT. Biofarma dan Sinovac Biotech China berkomitmen untuk memenuhi data-data tersebut, sehingga pemberian izin dapat segera dilakukan oleh Badan POM sesuai dengan rencana vaksinasi yang ditetapkan oleh Pemerintah,” terang Penny.
Mengingat kebutuhan akan vaksin yang mendesak di masa pandemi ini, Badan POM memberikan fleksibilitas terkait penerbitan izin edar vaksin covid-19 melalui simplifikasi prosedur dan persyaratan, tanpa mengabaikan aspek keselamatan manusia dan kualitas vaksin. Dalam hal ini, izin dikeluarkan dalam bentuk perizinan penggunaan vaksin dalam kondisi darurat atau Emergency Use Authorization (EUA).
Kepala Badan POM menegaskan bahwa setelah vaksin mendapat persetujuan penggunaan, pengawalan mutu vaksin di sepanjang jalur distribusi nantinya akan menjadi tanggung jawab dari industri farmasi dan distributor yang ditunjuk. "Dalam proses penyaluran di sarana pemerintah diperlukan peran aktif berbagai pihak sesuai kewenangan masing-masing," paparnya.
Penny berharap semua pihak berkomitmen dan saling mendukung untuk bersama mengupayakan keberhasilan rencana pelaksanaan vaksinasi dalam rangka penanganan pandemi covid-19 di Indonesia.
Dalam pelaksanaan vaksinisasi nanti, Badan POM mengimbau masyarakat agar melaporkan kepada tenaga kesehatan di tempat memperoleh vaksinasi jika mengalami KTD setelah divaksin atau melaporkan secara langsung ke Badan POM melalui HaloBPOM 1500533 atau aplikasi BPOM Mobile.
Tenaga kesehatan juga diharapkan untuk dapat secara aktif melaporkan Kejadian Ikutan Pasca Imunisasi (KIPI) secara berjenjang kepada Komite Daerah KIPI–Komite Nasional KIPI melalui website keamanan vaksin www.keamananvaksin.kemkes.go.id dan kepada Pusat Farmakovigilans/MESO Nasional Badan POM melalui subsite https://e-meso.pom.go.id.(H-1)
Badan Pengawas Obat dan Makanan (POM) diminta membuat aturan yang fair tentang bahaya Bisfenol A (BPA) di galon air sekali pakai berbahan PET (polietilen tereftalat).
Pelabelan BPA merupakan langkah nyata pemerintah dalam melindungi kesehatan konsumen dari risiko BPA yang memiliki efek negatif pada kesehatan publik.
Tren ancaman penyakit di Indonesia sudah mulai bergeser dari penyakit menular menjadi tidak menular.
Badan POM dan BRIN melakukan studi asesmen kesiapan BPOM untuk adopsi kecerdasan buatan atau artificial intelligence (AI).
Aturan anyar BPOM tersebut sejalan dengan Undang-Undang Perlindungan Konsumen yang bertujuan melindungi hak-hak konsumen, termasuk hak untuk mendapatkan informasi yang benar.
Harga obat yang tinggi di Indonesia terjadi karena 90% bahan baku obat masih impor
Prof. Hinky juga menampik klaim keliru yang beredar di media sosial, yaitu anak yang tidak divaksinasi bebas dari infeksi telinga dan pengobatan antibiotik.
Dikuatirkan informasi sequence genomic pathogen dari indonesia dikapitalisasi oleh pengembang vaksin negara maju dan kita tidak dapat benefit yang setara.
Di samping PABS hal lain yang perlu diperhatikan yaitu pendanaan dan transfer teknologi.
Isu efek samping vaksin covid-19 AstraZeneca. Ia mengatakan peringatan soal efek sampik dari roduk vaksin itu sudah diumumkan sejak 2021.
Menteri Kesehatan Budi Gunadi Sadikin menanggapi kehebohan soal efek samping vaksin covid-19 AstraZeneca. Menurut Budi, efek samping vaksin tersebut telah diketahui sejak lama.
Komisi Nasional Pengkajian dan Penanggulangan Kejadian Ikutan Pasca-Imunisasi memastikan sampai saat ini tidak ada kejadian sindrom trombosis dengan trombositopenia.
Copyright @ 2025 Media Group - mediaindonesia. All Rights Reserved